这里以采用钴酸锂为正极材料、石墨为负极材料为例来介绍锂离子电池的化学原理。在充电过程中,锂离子从正极中脱出,然后嵌入到负极石墨材料中,形成锂离子的石墨嵌入化合物;而在放电过程中,锂离子从石墨嵌入化合物中脱出,重新嵌入到正极材料中。锂离子电池充放电时,相当于锂离子在正极和负极之间来回运动,因此锂离子电池最初被形象地称为“摇椅式电池”(racking chair battery)。
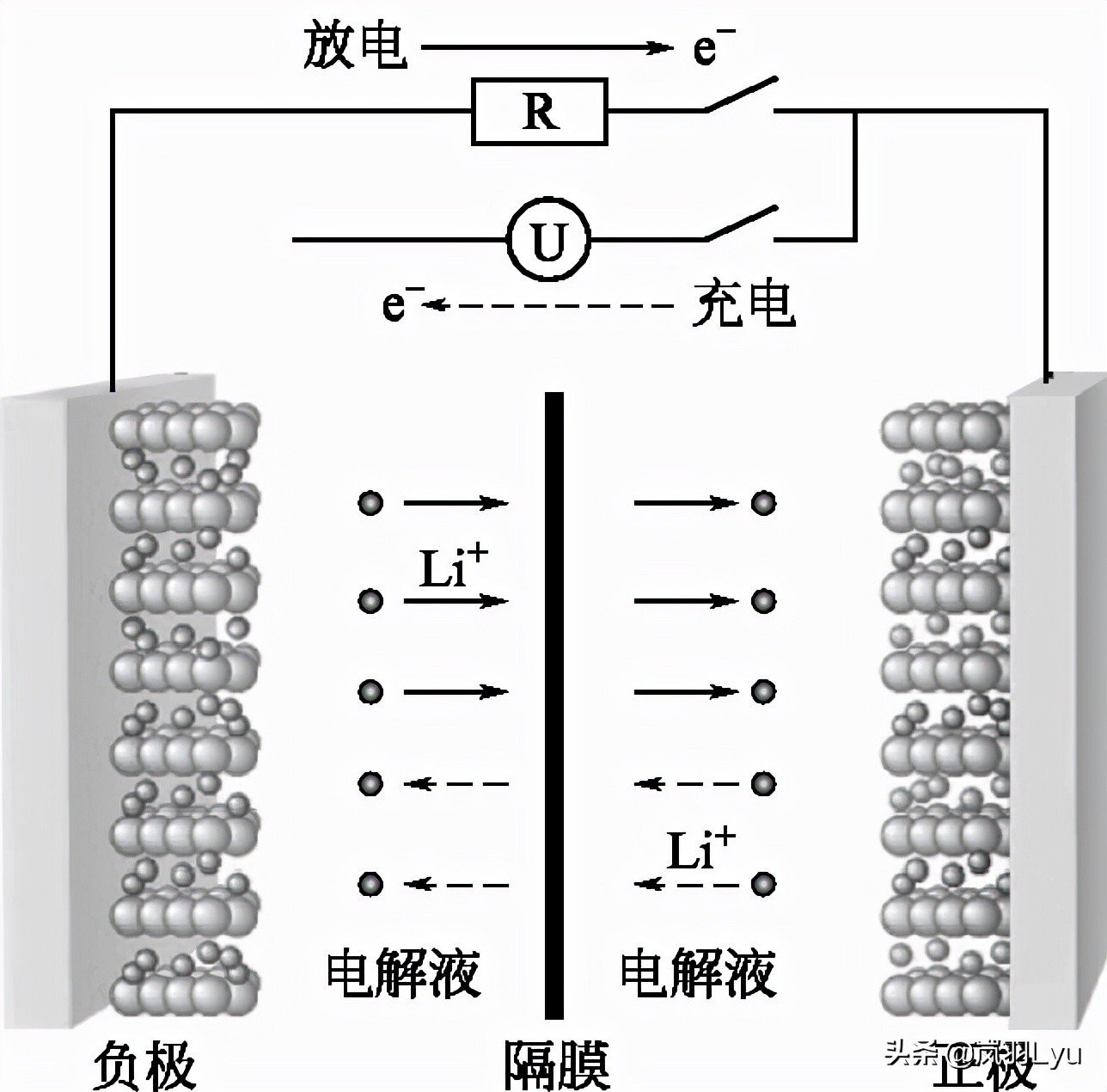
锂离子电池反应原理图(钴酸锂和石墨层状化合物)
锂离子电池在充放电时,正负极材料的化合价会发生变化。在常温常压下发生总的氧化还原反应如下
放电过程中的电极反应为:

正极(还原反应,得电子):

负极(氧化反应,失电子):

充电过程中的电极反应与上述反应过程相反。
因此,当采用钴酸锂为正极材料和石墨为负极材料时,由于上述氧化还原反应具有良好的可逆性,锂离子电池循环性能优异;由于石墨嵌锂化合物密度低,锂离子电池质量比能量高;由于氧化还原电对的电位在金属电对中最负,锂离子电池的工作电压和比能量高。
由反应式可以看出,理论上锂离子电池的正负极活性物质分别为和,但是由于和制备过程复杂,且在空气中不稳定,难以直接制造电池。因此,人们通常采用反应式的生成物钴酸锂和石墨作为正负极原材料装配成电池,此时电池处于没有电的状态,只有充电以后上述两种材料转化为活性物质才能自发放电,向外界提供电能。
本站声明:网站内容来源于网络,如有侵权,请联系我们,我们将及时删除。
文章链接:https://www.btchangqing.cn/448138.html
更新时间:2023年01月25日
本站大部分内容均收集于网络,若内容若侵犯到您的权益,请联系我们,我们将第一时间处理。

